است گرما انرژی در حال انتقال که تنها زمانی تشخیص داده می شود که از مرز یک سیستم ترمودینامیکی عبور کند . 1 هنگامی که در داخل سیستم، یا در محیط اطراف (اگر انتقال از داخل به بیرون باشد)، گرمای منتقل شده بخشی از انرژی داخلی سیستم (یا محیط اطراف) می شود. بنابراین، اصطلاح گرما باید به عنوان انتقال حرارت درک شود و زمانی رخ می دهد که بین سیستم و محیط اطراف آن یا بین دو ناحیه از سیستم اختلاف دما وجود داشته باشد. اگرچه قوانین یا اصول ترمودینامیک جهتی را برای فرآیند تعیین نمی کنند، اما از نظر تجربی همیشه مشاهده می شود که گرما از ناحیه ای با دمای بالاتر به منطقه ای با دمای پایین تر جریان می یابد. جریان خالص گرما بین دو سیستم در یک دما صفر است، به این معنی که هر دو منطقه با سرعت یکسان تبادل گرما می کنند.
طبیعت گرما

غالباً در گفتار محاوره ای از عباراتی مانند مقدار گرمای بدن یا افزایش گرما استفاده می شود و این کار به این دلیل انجام می شود که باعث سوء تفاهم نمی شود و شاید به دلیل وجود جایگزین فنی که اینقدر شهودی باشد اما از نظر فنی نادرست است. . گرما، که از فیزیک دیده می شود، در دسترس نیست ، گرما یک انتقال است . 2 آنچه بدن دارد انرژی حرارتی است . بهتر است اگر بدن به عنوان یک سیستم ترمودینامیکی در نظر گرفته شود ، انرژی کل سیستم به دو صورت ماکروسکوپی و میکروسکوپی است . انرژی ماکروسکوپی آن چیزی است که سیستم با اشاره به منشا خارجی مانند انرژی جنبشی و پتانسیل دارد . میکروسکوپی درجه فعالیت مولکولی آن است که مستقل از سیستم مرجع خارجی است و همان چیزی است که به عنوان انرژی داخلی سیستم شناخته می شود و با آن نشان داده می شود. U .
مولکول های یک سیستم با سرعت معینی حرکت می کنند. آنها همچنین به طور نامنظم می چرخند و ارتعاش می کنند و تمام این حرکت به آنها انرژی جنبشی می دهد که بخشی از انرژی درونی است که انرژی محسوس است، زیرا سرعت متوسط مولکول ها متناسب با دما است که ما می توانیم درک کنیم. اما مولکولها همچنین توسط نیروهای جاذبهای که در جامدات قویتر، کاهش مایعات و حتی بیشتر از آن در گازها هستند، متحد میشوند، به طوری که یک سیستم در حالت گازی متضمن انرژی است که برای غلبه بر نیروهای بین مولکولی لازم بوده است. این انرژی که مربوط به فازی است که سیستم در آن قرار دارد، انرژی نهفته نامیده می شود . اتم ها توسط پیوندهایی که در واکنش های شیمیایی تشکیل شده و شکسته می شوند، در کنار هم نگه داشته می شوند. انرژی درونی مرتبط با پیوندهای اتمی است انرژی شیمیایی . و در نهایت، نیروهای جاذبه در هسته اتم ها انرژی هسته ای را تشکیل می دهند که در واکنش های هسته ای آزاد می شود. تمام این اشکال انرژی در داخل سیستم ذخیره شده و آن را تشکیل می دهند انرژی درونی .
اما اشکالی از انرژی وجود دارد که نمیتوان آنها را ذخیره کرد، که تنها زمانی ظاهر میشوند که تعامل وجود داشته باشد و چیزی را تشکیل میدهند که ما آن را انرژی به دست آمده یا از دست رفته توسط سیستم مینامیم. این اشکال انرژی عبارتند از انتقال حرارت و کار . هنگامی که منشا یا نیروی محرکه برهمکنش اختلاف دما باشد، می گوییم که آن گرما است . است وگرنه کار .
به طور خلاصه، بسیار متداول است که به انرژی محسوس و نهان به عنوان گرما اشاره کنیم، و این در محاوره خوب است، اما در واقع انرژی حرارتی است که با انتقال حرارت بسیار متفاوت است.
تاریخچه نظریه گرما
اولین اشاره رسمی به اهمیت آتش در هراکلیتوس (540 قبل از میلاد تا 475 قبل از میلاد) یافت می شود که معتقد بود آتش منشأ اولیه ماده است.
برای آناکسیمن ، گرم و سرد حالت های رایج ماده هستند. او آنچه را که فشرده و متراکم میشود سرد میدانست و آنچه کمیاب و «شل» است گرم است، از این رو، به گفته وی، «نادری» دلیل گرم شدن اشیا تا زمانی است که بخار میشوند.
ارسطو (384 قبل از میلاد – 322 قبل از میلاد)، دو جفت کیفیت اساسی را اضافه کرد: گرم و سرد، خشک و مرطوب. دلیل اینکه یک جسم دارای دمای معینی است با توجه به مقادیری است که این دو کیفیت اساسی در آن یافت می شود.
جالینوس (129-199) مقیاس کیفی متشکل از چهار حالت گرما و چهار حالت سرد را پیشنهاد کرد که نقطه خنثی با افزودن چهار قسمت آب جوش و چهار قسمت یخ به دست میآید. 3
این ایده ها برای بیش از 23 قرن وجود داشت. جالب است بدانیم که در این دوره قبلاً درک می شد که برخی از پدیده های فیزیکی مانند انبساط جامدات و مایعات و انبساط حرارتی هوا و بخار به گرما بستگی دارد، اما به دما توجهی نمی شد. آنها جزئی از ویژگیهایی بودند که در فیزیک ارسطویی به آنها اشاره شده است .
ایده های ارسطو در اواسط قرن شانزدهم مورد تردید قرار گرفت ، زمانی که او وجود یک ذات ماده را مطرح کرد، وجود یک عامل جهانی که مسئول تمام واکنش های شیمیایی است. رابرت بویل (1627-1691) هرگونه ماهیت جسمانی را برای آتش انکار می کرد و معتقد بود که باید وحدت خاصی از ماده وجود داشته باشد، که دلالت بر آن دارد که باید از اجسام تشکیل شده باشد.
در حالی که در قرن هفدهم و سال های اول قرن هجدهم، بحث هایی درباره ساختار ماده مطرح شد و رویداد مهم دیگری در تاریخ گرما رخ داد، گئورگ استال (1660-1734) نظریه فلوژیستون را اعلام کرد . این را نباید با آتش مادی اشتباه گرفت که در هنگام احتراق در شعله و گرما ظاهر می شود، بلکه عنصری غیرقابل دسترس است که همه اجسام قابل احتراق دارند.
در طول قرن هفدهم ، دو نظریه در مورد گرما مخالفت کردند، نظریه فلوژیستون ، و پیروان اتم شناسان یونانی که جسمانی بودن آتش را پذیرفتند، با توجه به اینکه آتش از ذرات کوچک، سبک و ظریف تشکیل شده است، دفاع کردند. که به نوبه خود تحرک بسیار زیادی برای نفوذ به ماده در حالات مختلف آن داشتند که می توانستند به سادگی با حضور خود به شکل یک مایع غیر قابل تصور و کالری عمل کنند . لاووازیه بین سالهای 1775 و 1787 نظریهای درباره گازها ارائه کرد که در آن اصل کالری را معرفی کرد. در این دوره مفهوم دما مطرح شد و دماسنج هایی برای اندازه گیری سردی اشیا ساخته شدند. جوزف بلک (1728-1799) از این دماسنجها برای مطالعه گرما استفاده کرد و مشاهده کرد که چگونه مواد مختلفی که در دماهای نابرابر قرار داشتند در تماس با یکدیگر به تعادل میرسند. 4
در سال 1798 بنجامین تامپسون ، ارل رامفورد، در باواریا مشاهده کرد که هنگام حفاری توپ، مقدار گرمای بدست آمده به وضعیت مته بستگی دارد و به این نتیجه رسید که گرما یک سیال نیست، بلکه نوعی حرکت است. او امکان تولید مقدار نامحدود گرما توسط اصطکاک را استنباط کرد ، زیرا گرمای تولید شده تقریباً متناسب با کار انجام شده بود، واقعیتی که به راحتی با نظریه کالری قابل بحث نبود. در سال 1812 هامفری دیوی فرض فوق را تأیید کرد. این ایده در کار پزشک و فیزیکدان خولیو آر. فون مایر در سال 1842 و بعد از آن، و به طور قطعی در سال 1850 با جیمز پرسکات ژول به اوج رسید، که ثابت کرد گرما و کار چیزی بیش از مظاهر انرژی حرارتی نیستند که می توانند به عنوان تبدیل شوند. درصدی برای کار، در حالی که کار می تواند به طور کامل به گرما تبدیل شود. 5
در نهایت تأیید شد که گرما را نمی توان به عنوان یک ماده مادی درک کرد، بلکه آن را نوعی انرژی دانست. اندازه گیری معادل مکانیکی گرما پایان تئوری کالری را نشان می دهد. از همه اینها ترمودینامیک و از آن موتور حرارتی ناشی می شود . همزمان با شروع ترمودینامیک، تئوری مولکولی ماده در حال توسعه بود، که اجازه میدهد ایدهای منسجم از گرما و پدیدههای مرتبط شکل بگیرد. نظریه جنبشی گازها بسیاری از پدیده هایی را توضیح می دهد که با استفاده از نظریه کالری قابل توضیح نیستند.
گرمای ویژه
گرمای ویژه پارامتری است که به ماده بستگی دارد و گرمایی را که با افزایش دما به یک جرم معین از یک ماده ارائه می شود، مرتبط می کند:
س = متر 🔻 تی من تی f ج د تی
جایی که:
- س گرمای تامین شده به سیستم است.
- متر جرم سیستم است.
- ج است . گرمای ویژه سیستم
- تی من y تی f به ترتیب دمای اولیه و نهایی سیستم هستند.
- د تی است . اختلاف دما
واحدهای گرمای ویژه هستند جی / ( ک g . ک ) گرمای ویژه یک ماده به دمای آن بستگی دارد. با این حال، در بسیاری از فرآیندهای ترمودینامیکی تغییرات آن به حدی کم است که می توان گرمای ویژه را ثابت در نظر گرفت.

اگر گرمایش یک مایع در نموداری نشان داده شود که مقادیر گرما در واحد جرم را حمل می کند q طبق دستور و دما تی به عنوان آبسیسا. بین هر دو دما، میانگین گرمای ویژه بیان می شود: 6
ج متر = q 2 – q 1 تی 2 – تی 1 = برنزه ب
که در آن q 2 – q 1 مقدار گرمایی است که ماده بین دماها دریافت یا از دست می دهد تی 1 y تی 2 . با این حال، گرمای ویژه واقعی برای تی 1 خواهد بود
ج = لیم تی 2 – تی 1 → 0 q 2 – q 1 تی 2 – تی 1 = د q د تی = برنزه آ
گرمای ویژه واقعی با تغییر مقدار حرارت مبادله شده در واحد جرم با توجه به دما یا به صورت گرافیکی با شیب مماس هندسی در نقطه منحنی حالت به دست می آید. در شکل می توان تفاوت بین گرمای ویژه واقعی که با شیب مماس ها به منحنی نشان داده می شود و میانگین گرمای ویژه بین دو دما که با شیب وتر که به هر دو نقطه می پیوندد نشان داده شده است.
برای اکثر اجسام، گرمای ویژه با دما افزایش مییابد و تفاوت بین مقادیر متوسط و واقعی کم است، مشروط بر اینکه تغییرات دما نیز کم باشد. برای آب، منحنی qt عملاً یک خط مستقیم است، که نشان میدهد گرمای ویژه آن، در محدودههای معین، عملاً ثابت میماند، معمولاً 4186 کیلوژول بر کیلوگرم در نظر گرفته میشود.
گرمای ویژه مولی
اغلب بسیار مفید است که در مورد گرمای ویژه مولی که با سانتیمتر مول مشخص می شود صحبت کنیم و به عنوان مقدار انرژی لازم برای افزایش دمای یک مول از یک ماده به میزان 1 درجه تعریف می شود، یعنی با تعریف زیر تعریف می شود:
ج متر = 1 n د س د تی ≈ س n D تی
که در آن n تعداد مول های موجود در ماده را نشان می دهد.
ظرفیت حرارتی
ظرفیت گرمایی یک ماده قدری است که نشان دهنده دشواری بیشتر یا کمتری است که ماده مذکور برای تجربه تغییرات دما تحت عرضه گرما ایجاد می کند. با نشان داده می شود سی ، در اندازه گیری می شود جی / ک ، و به این صورت تعریف می شود:
سی = س D تی
با توجه به:
ج = س متر D تی ⟹ متر ج = س D تی ⟹ سی = متر ج
به طور مشابه، ظرفیت گرمایی مولی را می توان به صورت زیر تعریف کرد:
سی n = n ج
تغییرات فاز
در طبیعت سه حالت معمول ماده وجود دارد: جامد ، مایع و گاز . با اعمال گرما به یک ماده، می تواند از حالتی به حالت دیگر تغییر کند. این فرآیندها به عنوان تغییرات فاز شناخته می شوند . تغییرات فاز احتمالی عبارتند از:
-
- از حالت جامد به مایع که ذوب نامیده شود می
- از حالت مایع به جامد که انجماد نامیده می شود ،
- از حالت مایع به گاز، که تبخیر یا تبخیر نامیده می شود ،
- از حالت گازی به مایع به نام تراکم ،
- از حالت جامد به گاز که تصعید پیشرونده نامیده می شود .
- از حالت گازی به جامد که تصعید یا رسوب پسرونده نامیده می شود.
- از حالت گازی به پلاسما نامیده می شود که یونیزاسیون .
- از حالت پلاسما به حالت گازی که دیونیزاسیون نامیده می شود

گرمای نهان
اینکه یک جسم جامد می تواند با یک مایع یا یک گاز در تعادل گرمایی باشد، یا اینکه یک مایع و یک گاز می توانند در محدوده وسیع دما با یکدیگر در تعادل گرمایی باشند، طبیعی و مکرر است. اما چیزی که چندان طبیعی نیست این است که دو فاز یا حالت تجمعی مختلف از یک ماده می توانند به طور طبیعی تحت شرایط مناسب با یکدیگر در تعادل حرارتی باشند.
یک سیستم متشکل از اشکال جامد و مایع یک ماده معین، در یک فشار ثابت معین، می تواند در تعادل حرارتی باشد، اما فقط در دمایی به نام نقطه ذوب، که گاهی اوقات نمادی از آن است. تی f . در این دما، تمام گرمای اضافه شده در ذوب تا زمانی که یک ذره جامد باقی میماند، مواد صرف میشود، بدون اینکه تغییر قابل توجهی در دمای آن ایجاد شود. مقدار انرژی همجوشی می نامند اضافه شده را گرمای همجوشی ، گرمای نهان همجوشی یا آنتالپی و برای هر ماده متفاوت است. با نشان داده می شود L f .
برای رفتن از مایع به جامد، به همان مقدار انرژی نیاز است، بنابراین گرمای همجوشی نشان دهنده انرژی لازم برای تبدیل از حالت جامد به مایع و بالعکس است.
به طور مشابه، یک مایع و یک بخار از یک ماده می توانند در دمایی به نام نقطه جوش که نماد آن است در تعادل حرارتی باشند. تی ه . گرمای لازم برای تبخیر یک ماده در حالت مایع (یا متراکم کردن یک ماده در حالت بخار) را گرمای جوش یا گرمای نهان جوش یا آنتالپی جوش می گویند و با واحدهای گرمای نهان اندازه گیری می شود. از همجوشی با نشان داده می شود L ه .
جدول زیر 7 مقادیری از نقاط ذوب و جوش و گرمای نهان همجوشی و تبخیر برخی از مواد را نشان می دهد:
| مواد | تی f [°C] | L f [کیلوژول/کیلوگرم] | تی ه [°C] | L ه [کیلوژول/کیلوگرم] |
| آب یخ | 0، 00 | 334 | 100، 00 | 2260 |
| الکل اتیلیک | -114, 00 | 105 | 78، 3 | 846 |
| استون | -94، 3 | 96 | 56، 2 | 524 |
| بنزن | 5، 5 | 127 | 80، 2 | 396 |
| آلومینیوم | 658، 7 | 322-394 | 2300 | 9220 |
| قلع | 231، 9 | 59 | 2270 | 3020 |
| هیرو | 1530 | 293 | 3050 | 6300 |
| فلز مس | 1083 | 214 | 2360 | 5410 |
| مرکوریو | -38، 9 | 11، 73 | 356، 7 | 285 |
| رهبری | 327، 3 | 22، 5 | 1750 | 880 |
| پتاسیم | 64 | 60، 8 | 760 | 2080 |
| سدیم | 98 | 113 | 883 | 4220 |
انتقال حرارت
به طور کلی، سه راه مختلف برای انتقال گرما پذیرفته می شود: از طریق رسانش، توسط همرفت و توسط تابش. به بیان دقیق، فقط رسانایی و تابش اشکال انتقال گرما هستند که منحصراً به وجود عدم تعادل حرارتی بستگی دارد. مورد همرفت همچنین به انتقال مکانیکی جرم بستگی دارد، با این حال، از آنجایی که هنوز انتقال گرما از ناحیه ای با دمای بالاتر به منطقه ای با دمای پایین تر وجود دارد، بیان انتقال حرارت به وسیله همرفت پذیرفته می شود.
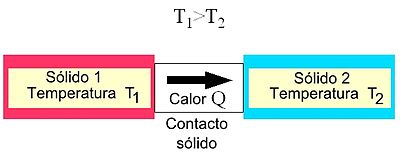
- رسانش حرارتی : هرگاه در یک محیط جامد گرادیان دما وجود داشته باشد، گرما از ناحیه یا جسمی با دمای بالاتر به ناحیه یا جسمی با دمای پایینتر جریان مییابد.
- همرفت حرارتی : از دو مکانیسم تشکیل شده است که همزمان عمل می کنند. ، که می تواند در مورد شیب چگالی طبیعی یا در مورد فن یا اجباری باشد انتقال انرژی تولید شده توسط حرکت مولکولی، یعنی هدایت و انتقال انرژی از طریق حرکت قطعات سیال که توسط یک نیروی خارجی هدایت می شود . یک پمپ
- تابش حرارتی : همه اجسام تابش الکترومغناطیسی با شدتی که به دمای آن و طول موج در نظر گرفته شده بستگی دارد ساطع می کنند.
انتقال ساده، یعنی منحصراً به دلیل یکی از سه راه، در عمل وجود ندارد و همیشه به طور همزمان رخ می دهد، حداقل با ترکیبی از دو راه انتقال و اغلب با هر سه راه.
اندازه گیری گرما
اگر جسمی در تعادل ترمودینامیکی داشته باشید و آن را در محیطی با دمای متفاوت رها کنید، انتقال انرژی بین بدن و محیط اطراف تا رسیدن به تعادل حرارتی وجود دارد ، یعنی تا زمانی که هر دو در یک دما باشند. ، در این مرحله انتقال متوقف می شود. گفته می شود که انرژی به شکل گرما منتقل شده است.
ترمودینامیک تعیین کنیم حالتهای تعادلی را مطالعه میکند و به ما اجازه میدهد، طبق قانون اول ، تفاوت گرما را بین حالت ۱ و حالت ۲، هم در جسم و هم در محیطی که در آن غوطهور شده است، . اگر بپذیریم که به دلیل اختلاف دما بیش از آن برهمکنشی وجود نداشته است، تغییرات انرژی درونی بدن و محیط با هم برابر است و هم یکی و هم دیگری از مقدار گرمای لازم برای خروج از حالت 1 خبر می دهند. به حالت 1. 2، اما آنها چیزی در مورد چگونگی جریان گرما بین هر دو حالت و همچنین زمان لازم برای انتقال به ما نمی گویند.
- د س = د U = U 2 – U 1
به عنوان شکلی از انرژی، گرما دارای واحدهای انرژی است ، بنابراین اگر به سیستم بینالمللی واحدها پایبند باشیم، با ژول اندازهگیری میشود. جی . 8 با در نظر گرفتن این که این واحد بسیار کوچک است و واحد جرم کیلوگرم است، کیلوژول معمولاً گرفته می شود. ک جی ، که به عنوان گرما تعریف می شود:
یک کیلوژول گرمایی است که باید به یک کیلوگرم آب منتقل شود تا دمای آن تقریباً 0.24 کلوین افزایش یابد. 9
هنگامی که نیاز به دانستن جریان گرما یا مقدار گرمای منتقل شده در واحد زمان باشد، آنچه به دنبال آن است د س / د تی و بر حسب kJ/s یعنی بر حسب کیلووات اندازه گیری خواهد شد. محاسبه جریان گرما و روشهای انتقال آن با ترمودینامیک مطابقت ندارد، بلکه مربوط به بخش دیگری از فیزیک است که انتقال حرارت است .
گرما یک قدر با جهت است، بنابراین برای تکمیل اطلاعات باید به آن علامت داد. توافق کاملی در مورد علامت متعارف وجود ندارد، اما پذیرفته ترین آنها عبارتند از:
انتقال حرارت به داخل سیستم مثبت و انتقال حرارت به خارج از سیستم منفی است. 10
کالری سنجی
برای تعیین مستقیم گرمایی که در یک فرآیند آزمایشگاهی آشکار می شود، اغلب از کالری سنج استفاده می شود . در اصل، این ظرفی است که حاوی مایعی است که در آن تغییرات انرژی توسط انتقال حرارت مورد بررسی قرار می گیرد، که پوشش آن باید کاملاً عایق باشد تا تضمین کند که فرآیند تا حد امکان به آدیاباتیک نزدیک است .
ترمودینامیک و انتقال حرارت
ترمودینامیک . از یک فرآیند گزارش میکند انتقال حرارت را بدون در نظر گرفتن مکانیسم جریان گرما یا زمان مورد نیاز برای تأثیر انتقال، یک مطالعه ترمودینامیکی بر اساس قانون اول یا اصل بقای انرژی ، تعیین می کند که چه مقدار گرما باید برای انتقال از یک حالت به حالت دیگر منتقل شود . از نقطه نظر مهندسی، مشکل کلیدی محاسبه نرخ انتقال حرارت برای یک اختلاف دما معین است. ترمودینامیک . با حالات تعادلی و تغییراتی که بین یک حالت تعادلی و حالت دیگر رخ می دهد سروکار دارد با این حال انتقال حرارت، ، با پدیدههایی سروکار دارد که از عدم تعادل حرارتی رخ میدهند و بنابراین نیاز به شرایط غیرتعادلی دارد. در نتیجه، مطالعه انتقال حرارت نمیتواند به تنهایی مبتنی بر اصول ترمودینامیک باشد، با این حال این قوانین فیزیکی که باید توسط یک فرآیند برآورده شوند، معادلاتی را ارائه میدهند که میتوانند در تحلیل مورد استفاده قرار گیرند.
راه برای اعمال قانون اول ترمودینامیک ایجاد یک حجم کنترلی است که یک ناحیه ثابت از فضا است که توسط یک سطح کنترل محدود شده و گرما، کار و جرم می توانند از آن عبور کنند. از آنجا می توان یک تعادل انرژی ایجاد کرد: 11
سرعتی که انرژی های حرارتی و مکانیکی وارد یک حجم کنترلی می شود، به اضافه سرعت تولید انرژی در حجم کنترل، منهای سرعت خروج انرژی های حرارتی و مکانیکی، باید برابر باشد، با سرعتی که انرژی در داخل انباشته می شود. این جلد
قبلاً اشاره کردیم که آنالیز ترمودینامیکی با سرعت انتقال حرارت در یک جهت سروکار ندارد، اما می توان گفت که این پارامتر به بزرگی گرادیان دما یا اختلاف دما در واحد طول یا نسبت یا رابطه تغییر دما بستگی دارد. در آن جهت هر چه گرادیان دما بیشتر باشد، سرعت انتقال حرارت بیشتر می شود.
انتقال حرارت در مهندسی
مسائل ظرفیت اسمی مربوط به تعیین نرخ انتقال حرارت در یک سیستم موجود با یک تفاوت معین در دما است. مسائل اندازه گیری مربوط به تعیین اندازه یک سیستم به منظور انتقال گرما با نرخ معین با اختلاف دما معین است. یک فرآیند یا تجهیزات انتقال حرارت را می توان به صورت تجربی یا تحلیلی تجزیه و تحلیل کرد. روش آزمایشی این مزیت را دارد که با سیستم فیزیکی واقعی سروکار دارد و به لطف آن، کمیت مورد نظر با اندازه گیری، در محدوده خطای آزمایشی تعیین می شود. روش تحلیلی این مزیت را دارد که سریع و ارزان است، اما نتایج بهدستآمده به دقت فرضیهها و ایدهآلسازیهای ایجاد شده در تحلیل بستگی دارد. در مطالعات انتقال حرارت، یک تقریب خوب اغلب با محدود کردن گزینهها به چند مورد، از طریق تجزیه و تحلیل، و سپس تأیید تجربی یافتهها به دست میآید.
احساس گرما در انسان
تلاش برای تعیین کمیت گرما به معنایی که از آن به صورت عامیانه و روزانه استفاده میکنیم، پیچیدهتر از آن چیزی است که به نظر میرسد، زیرا به متغیرهای بسیار بیشتری بستگی دارد و مهمتر از همه، غیرقابل پیشبینیتر از آنهایی است که تاکنون به آن اشاره شده است. شروع از کشور، منطقه، آب و هوا، عبور از درخشندگی یا رنگ غالب و حتی جنسیت و وضعیت روانی فرد می تواند بر حس حرارتی تأثیر بگذارد .
به طور کلی، در اکثر کشورها، زمانی که دما در هر زمانی از روز از 26 درجه سانتیگراد فراتر رود، از گرما صحبت می شود، اگرچه بسته به فصل سال بسیار متفاوت است. به عنوان مثال، 20 درجه سانتی گراد در تابستان دمای خنک و در زمستان این دما گرم یا گرم در نظر گرفته می شود.
پدیده ” موج گرما ” زمانی اعلام می شود که دمای روز از 32 درجه سانتیگراد بیشتر شود و دمای شب (یا در سپیده دم) به مدت سه روز به زیر 23 درجه سانتیگراد نرسد. تقریباً در همه انواع آب و هوا در طول فصل تابستان رایج است، به استثنای کشورهای نزدیک قطب، که در آنها بسیار نادر یا تقریباً وجود ندارد، و با نزدیکتر شدن کشورها به مناطق استوایی، شیوع آن بیشتر می شود. این نام موج گرما لزوماً به معنای گرمای بیش از حد یا دمای غیرمعمول برای فصل نیست، بلکه به منظور هشدار درباره عواقب مضر برای افراد یا گروههای آسیبپذیر است.
وقتی رطوبت بیشتری در محیط وجود دارد، احساس گرمای بیشتری خواهید داشت. به عنوان مثال، دمای 30 درجه سانتی گراد با رطوبت محیطی 10 درصد احساس می کند که محیط تنها 28 درجه سانتی گراد است. اما در رطوبت 90 درصد، 40 درجه سانتیگراد احساس می شود.





























