عنصر شیمیایی ماده خالصی است که با استفاده از روش های شیمیایی به مواد دیگر تجزیه نمی شود . عناصر مواد اولیه واکنش های شیمیایی هستند . کوچکترین مقدار ممکن از یک عنصر اتم است . همه اتم های یک عنصر دارای تعداد یکسانی پروتون در هسته هستند ( عدد اتمی ). بنابراین آنها ساختار یکسانی با پوسته الکترونی دارند و در نتیجه رفتار شیمیایی مشابهی دارند.
یک عنصر با نماد عنصر نشان داده می شود ، مخففی که بیشتر از نام لاتین عنصر گرفته شده است (به عنوان مثال، Pb از plumbum ، Fe از ferrum ). عناصر در جدول تناوبی بر اساس افزایش عدد اتمی مرتب شده اند . در مجموع 118 عنصر تا به امروز شناسایی شده است. از این میان، عناصر با اعداد اتمی از 1 تا 94 به طور طبیعی روی زمین وجود دارند، اما اغلب به شکل ترکیبات شیمیایی و گاهی اوقات فقط در آثار بسیار کوچک، به عنوان مثال. ب. به عنوان واسطه های کوتاه مدت در واپاشی رادیواکتیو . 80 عنصر از 118 عنصر شیمیایی شناخته شده حداقل یک عنصر پایدار دارندنوکلید .
فهرست مطالب
- 1داستان
- 1.1تاریخ مفهومی
- 1.2تاریخچه کشف
- 1.3سیستم سفارش
- 2مشخصات
- 2.1ایزوتوپ، نوکلید
- 3دسته جمعی
- 4عناصر خالص و مخلوط
- 5پیوندهای شیمیایی
- 6ظهور عناصر
- 7آمار عناصر شیمیایی
- 7.1فراوانی عناصر شیمیایی
- 8همچنین ببینید
- 9ادبیات
- 10پیوندهای وب
- 11موارد
داستان
تاریخ مفهومی
اصطلاح عنصر شیمیایی (از لاتین elementum به معنای عنصر ارسطویی به عنوان “آن چیزی که نمی توان بیشتر تقسیم کرد” [1] ) از قرن هفدهم ظهور کرد، زمانی که به طور فزاینده ای تشخیص داده شد که مفهوم عنصر کیمیا برای یک علم علمی مناسب نیست. توضیح خواص متنوع مواد و واکنش آنها به یکدیگر. [2] اتین دو کلاو گامی تعیین کننده انجام داد ، که در سال 1641 این تعریف را ارائه کرد که عناصر “مواد ساده ای هستند که مواد مخلوط از آنها تشکیل شده اند و مواد مخلوط در نهایت می توانند دوباره به آنها تجزیه شوند”. رابرت بویلدر سال 1661 یک نقد تأثیرگذار از نارسایی های کیمیاگری با عنوان کیمیای شکاک منتشر کرد. او در آن توضیح داد که عناصر شیمیایی را باید آن دسته از مواد اولیه دانست که «از مواد دیگر یا از یکدیگر به وجود نیامدهاند، بلکه اجزایی را تشکیل میدهند که مواد مخلوطی از آنها تشکیل شدهاند».
از یک سو، هر دو محقق با نظریه غالب کیمیاگران چهار عنصری مخالفت کردند ، که سعی میکرد همه مواد را از طریق مخلوطهای مختلف آتش ، آب ، هوا و خاک توضیح دهد و اصطلاح عنصر را برای تحقیقات تجربی دقیقتر در دسترس قرار دهد. از سوی دیگر، با این فرض که این عناصر نمی توانند به صورت جداگانه در واقعیت رخ دهند، اما هر ماده واقعی مخلوطی از همه عناصر در یک زمان است، به کیمیا وابسته باقی ماندند. بویل شک داشت که چنین عناصری وجود داشته باشداصلا کاملاً بر اساس روح مکانیکی که در آن زمان در حال ظهور بود ، او فرض کرد که موادی که یکنواخت به نظر می رسند از ذرات کوچک یکنواخت تشکیل شده اند که به نوبه خود از کوچکترین ذرات به روشی کاملاً مشخص تشکیل شده اند . او تنوع مواد و واکنشهای آنها را با روشهای ممکن بیشماری توضیح داد که از طریق آنها ذرات میتوانند این ذرات را که مشخصهی هر مادهای هستند، تشکیل دهند. در نتیجه بازآرایی اجسام ، او همچنین تغییری را که در کیمیاگری جستجو میشد ، ممکن دید، یعنی. اچ. تبدیل یک عنصر (به عنوان مثال سرب) به دیگری (مثلاً طلا ).
اما بویل راه را برای Antoine Laurent de Lavoisier هموار کرد ، که اجسام را به عنوان حدس و گمان متافیزیکی رد کرد ، اما در سال 1789 عناصر شیمیایی را با این واقعیت توصیف کرد که آنها نمی توانند به مواد دیگر تجزیه شوند. به طور دقیق تر: همه مواد باید به عنوان ابتدایی طبقه بندی شوند . اچ. تشکیل نشده است، تا زمانی که هیچ روشی برای جداسازی بیشتر اجزای جداگانه یافت نشد، اعمال شود. [3]
بر اساس این تعریف، مشاهدات بسیار دقیق لاووازیه از دگرگونی های شیمیایی و فیزیکی راه را برای شیمی مدرن باز کرد. به ویژه، او بقای جرم کل را در تمام تبدیلات شیمیایی کشف کرد و نسبت های جرمی دقیقی را که در آن عناصر خالص با یکدیگر واکنش می دهند، تعیین کرد. بدین ترتیب، جان دالتون به قانون تناسبات چندگانه هدایت شد که توانست در سال 1803 با فرض وجود کوچکترین ذرات ماده غیرقابل تغییر و تخریب ناپذیر ، یعنی اتم ها ، آن را به طور علمی اثبات کند. به گفته دالتون، یک عنصرتوسط نوعی اتم یکنواخت که می تواند با اتم های دیگر مطابق با قوانین ثابت ترکیب شود، تعریف می شود. رفتار متفاوت عناصر با این واقعیت توضیح داده می شود که انواع اتمی آنها در جرم ، اندازه و احتمالات پیوند با اتم های دیگر متفاوت است. این منجر به، در میان چیزهای دیگر، امکان تعیین جرم اتمی نسبی عناصر مختلف با یکدیگر، که اتم ها را برای اولین بار موضوع علوم تجربی قرار داد.
روش دالتون در تفسیر واکنشها و ترکیبات شیمیایی بسیار موفق بود. بنابراین ، تعاریف او از عنصر و اتم حفظ شد، حتی زمانی که مفروضات تغییرناپذیری اتم ها (به ویژه تقسیم ناپذیری آنها) و برابری همه اتم های یک عنصر در نهایت با مشاهدات روی عناصر رادیواکتیو کشف شده در سال 1896 رد شد: در 1902 ارنست. رادرفورد در نظریه تبدیل خود توضیح داد که سری واپاشی رادیواکتیودر نتیجه تقسیم اتم ها و تبدیل عناصر بیشتر. در سال 1910، فردریک سودی کشف کرد که اتم های یک عنصر رادیواکتیو می توانند در زنجیره های واپاشی مختلف با جرم های مختلف ( ایزوتوپی ) رخ دهند. از سال 1920 این پدیده ها در همه عناصر یافت شد.
در نیمه اول قرن بیستم، ساختار اتم به گونه ای مشخص شد که رفتار شیمیایی تا حد زیادی توسط لایه الکترونی اتم با بار منفی تعیین می شود ، که به نوبه خود توسط بار مثبت هسته اتم تعیین می شود . . بنابراین، مفهوم امروزی عنصر شیمیایی مبتنی بر بار الکتریکی هسته اتم است. این عدد با تعداد پروتونهای موجود در هسته به دست میآید که به آن عدد اتمی شیمیایی اتم یا عنصر گفته میشود.
با نگاهی به تعاریف اولیه واژه عنصر توسط کلاو، بویل و لاووازیه (نگاه کنید به بالا) و همچنین به مجموعههای بویل ، به نظر میرسد که بهترین تحقق این ایدهها، که در آن زمان فرضی بودند، از عناصر شیمیایی امروزی نشات نمیگرفت. و اتم ها، اما از بلوک های سازنده اتمی پروتون، نوترون ، الکترون داده می شود.
تاریخچه کشف

کریستال گوگرد

جیوه می ریزد
در دوران باستان و تا قرون وسطی ، اعتقاد بر این بود که جهان از چهار عنصر زمین ، آب ، هوا و آتش تشکیل شده است .
از عناصری که امروزه آنها را درک می کنیم، تنها ده عنصر در دوران باستان به شکل خالص آنها شناخته شده بود که یا به طور طبیعی (یعنی بومی ) وجود داشتند یا می توانستند از سنگ معدن ذوب شوند : کربن ، گوگرد ، آهن ، مس ، روی ، نقره ، قلع ، طلا و سرب جیوه . _ در طول تاریخ معادن قرون وسطی ، به ویژه در کوه های سنگ معدن ، مقادیر کمی از مخلوط های فلزات ناشناخته در سنگ معدن یافت شد.کشف و به نام ارواح کوهستانی ( کبالت ، نیکل ) نامگذاری شده است . سرانجام، کشف فسفر در سال 1669 توسط هنیگ برند ، عصر کشف اکثر عناصر، از جمله اورانیوم حاصل از پیچبلند توسط مارتین هاینریش کلاپروت در سال 1789 را آغاز کرد.
قبل از سال 1751، 9 عنصر زیر گروه زیر شناخته شده بودند: آهن ، کبالت ، نیکل ، مس ، روی ، نقره ، پلاتین ، طلا و جیوه ، و همچنین 8 عنصر گروه اصلی کربن ، فسفر ، گوگرد ، آرسنیک ، قلع ، آنتیموان ، سرب . و بیسموت . بنابراین در سال 1751 در مجموع 17 عنصر شناخته شد.
از سال 1751 تا 1800، 13 عنصر دیگر اضافه شد: هیدروژن ، تیتانیوم ، کروم ، منگنز ، ایتریم ، زیرکونیوم ، مولیبدن ، تنگستن ، اورانیوم ، نیتروژن ، اکسیژن ، کلر و تلوریم .
در دوره 1800 تا 1830، در مجموع 22 عنصر جدید کشف شد: عناصر زیرگروه وانادیوم ، تانتالیوم ، رودیم ، پالادیوم ، کادمیوم ، اسمیم ، ایریدیم و توریم خاکی کمیاب ، و همچنین عناصر گروه اصلی لیتیوم ، بریلیم ، سدیم ، منیزیم ، پتاسیم ، کلسیم ، استرانسیم ، باریم ، بور ، آلومینیوم ، سیلیکون , سلنیوم , ید و برم .
یازده عنصر دیگر بین سالهای 1830 و 1869 اضافه شد. آنها همچنین نشانگر وضعیت فنی – علمی توسعه بودند، زیرا عناصر سخت یافت و کمیاب نیز کشف و توصیف شدند. آنها هلیم ، روبیدیم ، سزیم ، ایندیم ، تالیم ، نیوبیم ، روتنیم ، لانتانیم ، سریم ، تربیوم ، اربیوم بودند . بنابراین، تا سال 1869، 63 عنصر کشف شد.
در طول قرن نوزدهم، فلزات کمیاب خاکی کشف شدند که تقریباً تمام عناصر طبیعی با آنها شناخته شده بودند. در طول این مدت، بسیاری از عناصر فرضی نیز فرض شدند که بعداً رد شدند، مانند سحابی . در قرن بیستم و آغاز قرن بیست و یکم، بسیاری از عناصری که در طبیعت وجود ندارند – عناصر فرااورانی – به طور مصنوعی تولید شدند، بخشی در راکتورهای هسته ای ، بخشی در شتاب دهنده های ذرات .. وجه مشترک همه این عناصر این است که ناپایدار هستند. این بدان معنی است که آنها با سرعت های مختلف به عناصر دیگر تبدیل می شوند. کشف چنین عناصر کوتاه مدت دیگری قابل انتظار است. هر کدام در مقادیر بسیار کم رخ می دهند. عناصر نام خود را از کاشفان خود دریافت کردند، که منجر به بحث و جدل نامگذاری عنصر در قرن بیستم شد . عناصری که هنوز ایجاد یا نامگذاری نشده اند، نام عناصر سیستماتیک نامیده می شوند .
سیستم سفارش
عناصر بر اساس عدد اتمی خود (عدد اتمی) و آرایش الکترونی اتم های آنها در جدول تناوبی عناصر (PSE) در گروه ها و دوره ها مرتب شده اند . این سیستم توسط دانشمند روسی دیمیتری ایوانوویچ مندلیف همزمان با دکتر و شیمیدان آلمانی لوتار مایر در سال 1869 پایه گذاری شد.
مشخصات

نمایش شماتیک اتم (نه در مقیاس، در غیر این صورت ناحیه نارنجی باید تقریباً 5 متر قطر داشته باشد)

الکترون های متحرک مسئول درخشش فلزات هستند (در اینجا آهن خالص)
عناصر شیمیایی با استفاده از واکنشهای تشخیص شیمی تحلیلی شناسایی میشوند .
بسیاری از خواص عناصر را می توان از ساختار اتم آنها به دست آورد. مدلهای مختلف اتمی که در طول تاریخ رشد کردهاند، بهویژه مدل موفق پوسته بور ، مبنای نظری را برای این امر فراهم میکند.
در حالت بدون بار الکتریکی، تمام اتمهای یک عنصر به تعداد پروتونهای هسته اتم در لایه الکترونی الکترون دارند. اگر عناصر بر اساس افزایش تعداد پروتون ها ( عدد اتمی ) در جدول تناوبی به اصطلاح مرتب شوند ، ویژگی های دوره ای تکرار شونده به دست می آید (به گروه اصلی ، زیر گروه مراجعه کنید ).
در واکنشهای شیمیایی، فقط الکترونهای روی لایههای بیرونی واکنشدهندهها مرتب میشوند، در حالی که هسته بدون تغییر باقی میماند. اتم ها در درجه اول “سعی” می کنند تا به پیکربندی گاز نجیب ( پایداری به دلیل بسته بودن پوسته بیرونی) دست یابند، حتی اگر این به قیمت خنثی بودن الکتریکی باشد ، و تنها در مرحله دوم برای یکسان سازی بار پیکربندی کلی تلاش می کنند. این “تلاش” با الکترونگاتیوی توصیف می شود . گازهای نجیب ، یعنی عناصری با پوسته بیرونی بسته در حالت خنثی، واکنش پذیری پایینی دارند و فقط در شرایط شدید ترکیباتی را تشکیل می دهند.
کوارتت اعداد کوانتومی “شناسایی” واضحی از الکترونهای یک عنصر ارائه میکند : عدد کوانتومی اصلی ، عدد کوانتومی ثانویه ، عدد کوانتومی مغناطیسی ، عدد کوانتومی اسپین ، یعنی ویژگیهای عنصر فیزیکی کوانتومی .
ایزوتوپ، نوکلید
همه اتم های یک عنصر دارای تعداد پروتون یکسانی هستند، اما می توانند حاوی تعداد متفاوتی از نوترون باشند . این گونهها که فقط در تعداد نوترونهایشان با هم تفاوت دارند، ایزوتوپهای عنصر مورد بحث هستند. اصطلاح کلی برای یک نوع اتم که با تعداد پروتون ها و نوترون ها تعیین می شود، نوکلید است .
به عنوان مثال، سه ایزوتوپ هیدروژن در رخدادهای طبیعی وجود دارد : پروتیوم (بدون نوترون)، دوتریوم (1 نوترون)، تریتیوم (2 نوترون). هسته رایج ترین ایزوتوپ هیدروژن1اچ(پروتیم، 99.9851٪) از یک پروتون تشکیل شده است. دوتریوم در هیدروژن طبیعی تنها با سهم 0.0149% و تریتیوم با کمتر از 10-10 % وجود دارد.
رایج ترین هسته هلیوم 4اچهاز دو پروتون و دو نوترون تشکیل شده است. با این حال، ایزوتوپ در رویدادهای طبیعی نیز با نسبت تنها 0.000137٪ وجود دارد.3اچههلیوم -3 که هسته آن فقط یک نوترون دارد.
کلر طبیعی (17 پروتون) از مخلوطی از ایزوتوپ ها با 18 نوترون (75.8٪) و 20 نوترون (24.2٪) تشکیل شده است.
دسته جمعی

قطعه مس
جرم اتمی ایزوتوپ ها تقریباً ، اما نه دقیقاً، مضربی صحیح از جرم اتم هیدروژن است . دلایل این انحرافات که کمتر از 0.9 درصد است عبارتند از:
- انرژی اتصال اجزای هسته اتم به عنوان یک نقص جرمی نشان داده می شود ، به طوری که جرم هسته همیشه کمی کوچکتر از مجموع جرم اجزای هسته است. این اثر در حوزه هسته های آهن و نیکل با 0.945 درصد به حداکثر خود می رسد.
- هسته اتم از پروتون و نوترون تشکیل شده است . نوترون ها 0.138 درصد سنگین تر از پروتون ها هستند.
- در اتم خنثی الکتریسیته، پروتون ها تنها با همان تعداد الکترون که 0.055 درصد از جرم پروتون را دارند، وجود دارند.
دو اثر آخر فقط تا حدی یکدیگر را جبران می کنند.
عناصر خالص و مخلوط

برم با بخار در آمپول
عناصر شیمیایی که تنها یک نوع اتم در ظاهر طبیعی خود دارند، عناصر خالص نامیده می شوند . از طرف دیگر، اگر از دو یا چند ایزوتوپ تشکیل شده باشند، عناصر مخلوط نامیده می شوند . اکثر عناصر عناصر ترکیبی هستند. 19 عنصر خالص پایدار و سه عنصر ناپایدار با عمر طولانی ( بیسموت ، توریم و پلوتونیوم ) وجود دارد ، بنابراین در مجموع 22 عنصر خالص وجود دارد.
در جدول تناوبی، عناصر مخلوط با میانگین جرم اتمی با توجه به فراوانی نسبی ایزوتوپ ها نشان داده می شوند. نسبت اختلاط طبیعی معمولاً برای یک عنصر ثابت است، اما می تواند به صورت محلی برای برخی از عناصر متفاوت باشد. به عنوان مثال ، سرب ، بسته به منشا آن ( رسوب ) میانگین جرم اتمی متفاوتی را نشان می دهد. در سال 2010، IUPAC تصمیم گرفت که در آینده برای عناصر هیدروژن ، بور ، لیتیوم ، کربن ، نیتروژن ، اکسیژن ، سیلیکون ، گوگرد ، کلرو تالیم در جدول تناوبی، جرم باید به عنوان محدوده جرمی مشخص شود . [4]
اصطلاحات ماده خالص و عنصر خالص و همچنین مخلوط مواد و عنصر مخلوط باید کاملاً از هم متمایز شوند.
پیوندهای شیمیایی
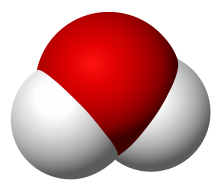
مدل پر کردن فضای مولکول آب ( H2O )

ساختار کریستالی کلرید سدیم
به استثنای چند گاز نجیب، عناصر شیمیایی می توانند پیوندهای شیمیایی ایجاد کنند . چندین اتم ابتدایی برای تشکیل مولکول ها ، بلورهای یونی ، کمپلکس ها یا ترکیبات فلزی ترکیب می شوند .
اگر عناصر با خود پیوندهای شیمیایی تشکیل دهند، ماده خالص را عنصر نیز می نامند : در بسیاری از گازها مانند کلر کلر یا فلوئور F، دو اتم از یک عنصر پیوند کووالانسی تشکیل می دهند و به یک مولکول عنصر تبدیل می شوند ، در اینجا Cl 2 و F 2 . علاوه بر O 2، اکسیژن نیز مولکول های O 3 سه اتمی کمتر پایدار را تشکیل می دهد ، در حالی که گوگرد، مولکول های حلقه ای شکل با شش تا هشت اتم را تشکیل می دهد.
هنگامی که عناصر با عناصر دیگر پیوند شیمیایی ایجاد می کنند، ترکیبات شیمیایی تشکیل می شوند . به عنوان مثال، آب با فرمول مولکولی H 2 O ترکیبی از عناصر هیدروژن H (2 اتم در هر مولکول) و اکسیژن (1 اتم در هر مولکول) است.
اساساً چهار نوع پیوند شیمیایی بین اتم های عناصر مختلف وجود دارد:
- ترکیبات مولکولی معمولاً از غیرفلز و غیرفلز تشکیل میشوند – آنها نارسانا هستند (از نظر الکتریکی غیر رسانا) با نقطه جوش عمدتاً پایین ( ترکیبات الماسمانند یا پلاستیک مانند با حذف مولکولهای غولپیکر ). علاوه بر آب، نمونه هایی از ترکیبات مولکولی شامل متان و شکر است .
- ترکیبات یا نمک های یونی اغلب از فلز ( کاتیون ) و غیر فلز ( آنیون ) تشکیل می شوند. آنها شکننده هستند، اغلب نقطه ذوب بالایی دارند و در مذاب یا محلول رسانای الکتریکی هستند . نمونه هایی از ترکیبات یونی اکسید آهن (II) و نمک معمولی ( کلرید سدیم ) هستند.
- مجتمع ها از یک ذره مرکزی تشکیل شده اند که توسط لیگاندها احاطه شده استبه عنوان مثال، کلروفیل یک ترکیب پیچیده است.
- ترکیبات فلزی از دو یا چند فلز تشکیل می شوند. اتم های فلز در اینجا با پیوندهای فلزی و نه به ندرت توسطپیوندهای یونی یا کووالانسی اضافی به هم متصل می شوند. آنها را نباید با آلیاژهایی که به عنوان مخلوط طبقه بندی می شوند
ظهور عناصر

در اواخر فاز درخشان خود، ستارگان سنگین همچنین هستههای اتمی سنگینتری تولید میکنند و مواد را به شکل ابر بیرون میاندازند، در اینجا: سحابیهای اطراف ستاره بسیار عظیم eta Carinae ، که در اثر فورانهای 100 تا 150 سال قبل به وجود آمدهاند.
عناصر سبک هیدروژن (تقریباً 75٪) و هلیوم (تقریباً 25٪) قبلاً در طول انفجار بزرگ به همراه مقادیر کمی لیتیوم و بریلیم تشکیل شده بودند . در آغاز کیهان شیمی هیدروژن با جرم اتمی نسبی حدود 1.0 u (یک پروتون) وجود دارد. عناصر سنگین تری در جهان در اثر واکنش های هسته ای در ستارگان ایجاد می شوند . در دنباله اصلی ، ستارگان، مانند خورشید ما ، در دمای بالا (چند میلیون درجه سانتیگراد) و فشار بالا ادغام می شوند.به عنوان مثال، چهار هسته هیدروژن از طریق چندین مرحله میانی برای تشکیل یک هسته هلیوم (جرم اتمی نسبی تقریباً 4.0 u ). این مقدار کمی سبکتر از چهار پروتون با هم است، تفاوت جرم به عنوان انرژی آزاد می شود .
این همجوشی (اتمهایی با تعداد پروتونهای پایینتر که با هم ترکیب میشوند و اتمهای بالاتر را تشکیل میدهند) در بیشتر ستارگان برای تشکیل کربن، در اتمهای پرجرم برای تشکیل آهن ، چگالیترین هسته، ادامه مییابد. این همیشه با آزاد شدن انرژی اتفاق میافتد ، در نتیجه با افزایش تعداد اتمی عناصر تشکیلشده تا آهن، بازده انرژی کاهش مییابد. واکنشهای همجوشی به هستههای سنگینتر نیاز به انرژی ورودی دارد .
بنابراین عناصر سنگینتر از آهن در اثر همجوشی هستهای ایجاد نمیشوند ، بلکه با جذب نوترون از اتمهای موجود، که به عناصری با عدد اتمی بالاتر تبدیل میشوند، ایجاد میشوند. این در مورد ستارگان کم جرم در فرآیند به اصطلاح s اتفاق می افتد ، در مورد ستاره های پرجرم در پایان عمر ستارگان در طول یک ابرنواختر در فرآیند r .
عناصر تشکیل شده وارد محیط بین ستاره ای می شوند (به طور مداوم از طریق باد خورشیدی یا به صورت انفجاری در یک ابرنواختر) و برای تشکیل نسل بعدی ستارگان یا سایر اجرام نجومی در دسترس هستند. بنابراین منظومههای ستارهای جوانتر از همان ابتدا حاوی مقادیر کمی از عناصر سنگینتر هستند که میتوانند سیاراتی مانند سیارات منظومه شمسی را تشکیل دهند .
آمار عناصر شیمیایی
از 118 عنصر شناخته شده (تا سال 2015)، 80 عنصر پایدار هستند. همه عناصر پایدار به طور طبیعی روی زمین وجود دارند، مانند 14 عنصر رادیواکتیو (به فراوانی عنصر مراجعه کنید ). عناصر رادیواکتیو دیگری نیز به طور مصنوعی تولید شدهاند و احتمالاً تعداد آنها همچنان در حال افزایش است.
عناصر را می توان بر اساس معیارهای مختلف تقسیم کرد. رایج ترین آنها تقسیم به عناصری است که فلزات را تشکیل می دهند و بخش عمده ای از عناصر را تشکیل می دهند و نافلزها و نیمه فلزات سطح متوسط .
تنها 17 عنصر از تمام عناصر به گروه غیرفلزها تعلق دارند، اینها در شرایط استاندارد تشکیل فلز نمی دهند . از این میان، شش گاز نجیب تکاتمی هستند، زیرا اتمهای آنها مولکول تشکیل نمیدهند. اچ. به یکدیگر واکنش نشان ندهید از سوی دیگر، برخی دیگر با اتم های همان عنصر ترکیب می شوند و مولکول هایی را تشکیل می دهند. اینها شامل پنج عنصر دیگر است که در شرایط عادی گازی هستند: هیدروژن (H2 ) ، نیتروژن (N2 ) ، اکسیژن (O2 ) ، فلوئور (F2 ) و کلر (Cl2 ) و همچنین برم مایع.(Br 2 ) و ید جامد (I 2 ).
فراوانی عناصر شیمیایی

فراوانی نسبی عناصر در پوسته زمین

سیلیکون پلی کریستالی

99.999٪ کریستال های گالیوم

قطعات لیتیوم در روغن پارافین برای محافظت در برابر اکسیداسیون
فراوانی عناصر شیمیایی بسته به منطقه مورد نظر متفاوت است.
در جهان، ارتباط نزدیکی با فرآیندهای شکل گیری در چارچوب زمانی کیهانی ( هسته سنتز ) دارد. در آنجا، تا حد زیادی رایجترین عنصر هیدروژن است و پس از آن سادهترین محصول همجوشی آن ، هلیم، که هر دو بلافاصله پس از انفجار بزرگ تشکیل شدند . عناصر متداول بعدی کربن و اکسیژن هستند . لیتیوم، بریلیم و بور نیز در بیگ بنگ تشکیل شدند، اما در مقادیر بسیار کمتر.
هلیوم، کربن و اکسیژن و سایر انواع اتم ها از همجوشی هسته ای در ستاره ها یا سایر فرآیندهای اخترفیزیکی تشکیل شده اند . اتم هایی با تعداد پروتون زوج ، مانند اکسیژن، نئون، آهن یا گوگرد، بیشتر تشکیل شده اند، در حالی که عناصر با تعداد فرد پروتون نادرتر هستند. این قانون به افتخار شیمیدان آمریکایی ویلیام دریپر هارکینز (1873-1951) نامگذاری شده است . فراوانی خاص آهن به عنوان نقطه پایانی همجوشی هسته ای احتمالی در ستاره ها قابل توجه است .
توزیع روی زمین با توزیعی که در سراسر جهان وجود دارد متفاوت است. به ویژه، مقادیر نسبتاً کمی از هیدروژن و هلیوم در زمین وجود دارد، زیرا این گازها نمی توانند توسط میدان گرانشی زمین نگهداری شوند . در منظومه شمسی آنها عمدتا در سیارات گازی مانند مشتری و نپتون یافت می شوند . در سیارات سنگی مانند زمین، عناصر سنگین تر، به ویژه اکسیژن، سیلیکون، آلومینیوم و آهن غالب هستند.
ارگانیسم ها عمدتاً از هیدروژن ، اکسیژن ، کربن و نیتروژن تشکیل شده اند .
عناصری که اغلب در منطقه مورد بررسی وجود دارند به عنوان عناصر حجیم و عناصر بسیار نادر به عنوان عناصر کمیاب شناخته می شوند .


